学术中心Academic Centers
学术中心Academic Centers
联系我们
微卫星不稳定那些事儿
浏览次数:4765 发布时间:2019-11-13
作者:李笑荣
一:什么是微卫星不稳定
微卫星为生物基因组中短核苷酸串联重复序列,由于其重复特性,在DNA复制过程中易生错误。在正常细胞中DNA错配修复系统纠正DNA复制过程出现的错误,确保复制过程的"保真性"。然而,当DNA错修( mismatch repair,MMR)基因(主要是MLH1、PMS2、MSH2、MSH6)发生胚系突变或体细胞MLH1启动子过度甲基化导致MMR蛋白表达缺失时,微卫星复制错误不能被纠正即发生MSI。
近些年,在我国结直肠癌发病率呈上升趋势。其发生途径按照分子变化分为(1)以DNA微卫星改变为特征的微卫星不稳定型(microsatellite instability,MSI);(2)以部分或整个染色体为途径的染色体不稳定型(chromosomal instability,CIN)。结直肠癌约15%经MSI途径发生。其中约12%为散发性 MSI 结直肠癌,发生机制为MLH1 基因启动子发生甲基化使该基因沉默、发生微卫星不稳定性而致的 CRC。此外,由 MLH1、 PMS2、 MSH2、 MSH6 等 MMR 基因发生胚系突变所致Lynch 综合征,约占3%。该综合征是一种常染色体显性遗传病。患者除了发生结直肠癌,还可发生子宫内膜癌、胆管细胞癌等肠外肿瘤。
图1 MSI途径发生的结直肠癌
MSI国际研究合作组织推荐对Bat26、Bat25、D5S346、D2S123和D17S250五个微卫星位点进行检测,根据微卫星位点不稳定的数量对MSI进行分类。(1)高频MSI(MSI–H):具有两个或两个以上位点改变;(2)低频MSI(MSI–L):仅有一个位点发生改变;(3)微卫星稳定型(MSS):没有位点发生改变。通常,由于MSI-L与MSS的临床表现无明显差别,所以将MSI-L划入MSS中。
二:为什么检测MSI结直肠癌MSI结直肠癌与MSS结直肠癌相比,在预后、治疗等方面均存在差异,而且与lynch综合征密切相关。MSI结直肠癌检测临床意义包括以下三个方面。
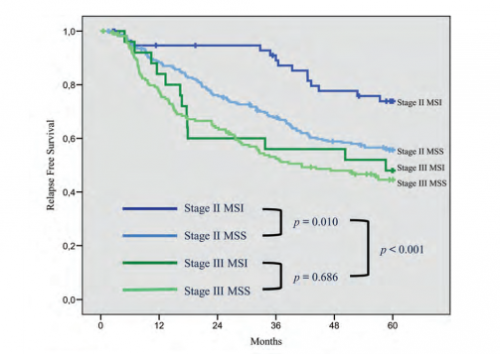
(1)预后性:临床研究发现,在Ⅱ期结直肠癌,MSI状态可作为预后的独立预测因子,
如图2所示,MSI-H Ⅱ期结直肠癌5年无复发生存率高于MSS Ⅱ期结直肠癌。即在Ⅱ期结直肠癌患者中,MSI-H状态提示良好预后。
图2 MSI-H Ⅱ期结直肠癌5年无复发生存率高于MSS Ⅱ期结直肠癌
(2)预测性:指导治疗
5-氟尿嘧啶(5-FU)是结直肠癌术后辅助治疗的重要化疗药物。Piero Benatti等开展回顾性研究发现,MSI-H Ⅱ期结直肠癌患者对5-FU治疗不敏感。NCCN指南指出MSI-H Ⅱ期结直肠癌患者有良好预后但不能从5-FU治疗获益。
(3)Lynch综合征的辅助诊断及筛查
Lynch综合征家族不仅发生结直肠癌的风险增高,还可以发生子宫内膜癌、卵巢癌以及胆管细胞癌等肠外肿瘤。从MSI-H结直肠癌中筛选出可疑患者,就个人而言早期诊断和预防性息肉切除术可以降低CRC死亡率。此外,还可以为患者家族成员提供肿瘤预防和筛查。研究表明,阿司匹林能够预防Lynch综合征相关肿瘤的发生。
三: 怎么检测MSI 微卫星不稳定?在MSI结直肠癌中,MSI是分子特征,DNA错配修复基因缺陷是分子特征。因此,目前可用免疫组化检测DNA错配修复(MMR)基因相关蛋白的表达,以及基于PCR检测多个微卫星位点。
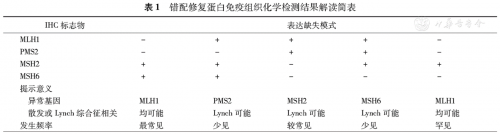
(1)免疫组化检测DNA错配修复蛋白:常规开展4 种MMR蛋白检测(MLH1、PMS2、MSH2、MSH6。错修复蛋白在正常肠腺上皮细胞以及淋巴细胞、平滑肌细胞、血管内皮细胞均表达,可作为内对照。对单个错修复蛋白来说,当内对照细胞核阳性而癌细胞全阴性(即没胞核着色)时,表明该蛋白表达缺失。总体上说,当肿瘤细胞出现一个或多个错修复蛋白缺失时,可判读为错配修复基因缺失( MMR deficient, dMMR),提示肿瘤为MSI-H;当肿瘤细胞无错修复蛋白缺失,判读为错配修复基因无缺失(MMR proficient, pMMR),提示肿瘤为 MSI-L 或 MSS。
图3 免疫组化检测结直肠癌DNA错修复基因(MLH1、PMS2、MSH2、MSH6)表达
(2)PCR检测多个微卫星位点:该方法通过PCR扩增特定的微卫星序列(Bethesda指南5个位点),然后通过基因分析仪测序,最终比较正常和肿瘤组织的微卫星长度差异。如前所述,然后根据微卫星位点不稳定的数量,判读为MSI–H(具有两个或两个以上位点改变)、MSI–L(仅有一个位点发生改变)、MSS(没有位点发生改变)。
总体来说,免疫组化和PCR两种检测方法的敏感度和特异性均在90 %以上,且文献报道二者一致率可以达到97.8 %以上。错修复蛋白免疫组化检测结果如表1所示,其中最常见的免疫组化表达模式为MLH1-/PMS2-和MSH2-/MSH6-。与PCR方法相比,IHC检测结果可以揭示缺失的基因种类,有利于下一步基因测序分析或进一步筛查Lynch综合征。免疫组化由于简单、经济且更易于在病理科开展推广。此外,免疫组化对组织样本量要求不高,穿刺活检也适用。所以,免疫组化检测结直肠癌组织MMR可以作为一种初筛的手段。需要注意的是,少数错义突变导致错修复蛋白功能异常,由于保留“抗原性”导致免疫组化检测出现假阳性。PCR方法则可互补,但由于技术相对复杂、费用较高使得在基层病理科较难推广。
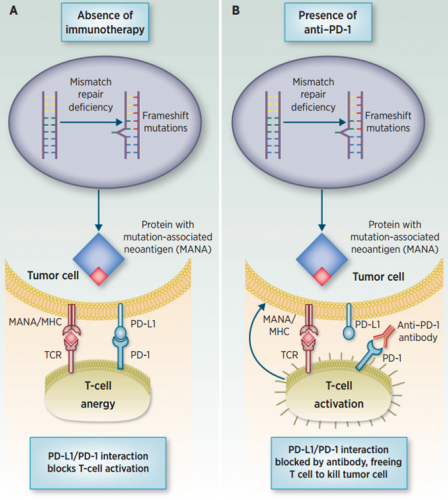
四 MSI与PD-1免疫治疗在正常的组织炎症反应中,PD-1/PD-L1通路是T细胞免疫反应的负反馈调节机制。肿瘤细胞通过高表达PD-L1与活化的T细胞表面PD-1结合,就像给免疫系统“踩刹车”。如果特异性阻断PD-1和PD-L1的结合即给免疫系统“松刹车”。各大药厂基于这样的原理研发一系列药物,如以PD-1为药物靶点的Pembrolizumab(Keytruda)、 Nivolumab(Opdivo),以PD-L1为靶点的Tecentriq、Durvalumab。且抗PD-1/PD-L1免疫治疗在黑色素瘤、非小细胞肺癌、膀胱癌、肾细胞癌等均有较好的治疗响应率。
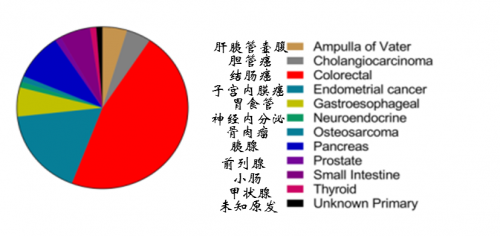
关于抗PD-1/PD-L1免疫治疗在结直肠癌中的作用,最初尝试的临床实验结果显示33例结直肠癌患者仅有1例得到缓解。得到缓解的这位患者与其他有何不同?2015年, Le DT等发表在New England journal of medicine里程碑式的发现:抗PD-1药物Pembrolizumab在错配修复缺陷(dMMR)的结直肠癌患者中反应率显著提高。该临床试验患者分成3组:A:10位错修复缺陷(dMMR)结直肠癌患者、B:18位错修复无缺陷(pMMR)结直肠癌患者、C:7位错修复缺陷(dMMR)的其他肿瘤(除了结直肠癌)。如表2所示,免疫相关客观反应率分别为40%、0、70%,免疫相关20周无进展生存率(%)分别为 78%、11%、67%。数据显示不仅dMMR的结直肠癌患者获益,而且dMMR的非结直肠癌患者,如子宫内膜癌、胆管癌、胰腺癌、前列腺癌、胃癌等也可从抗PD-1治疗获益。提示dMMR肿瘤患者均可从抗PD-1治疗获益。6月8日,Dung T. Le等science发表了《Mismatch-repair deficiency predicts response of solid tumors to PD-1 blockade》,该研究评估了PD-1抗体对12种dMMR肿瘤的治疗效果(图4),进一步证实了抗PD-1免疫治疗针对dMMR肿瘤患者的“实力”。
表2 MMR与抗PD-1临床实验数据
dMMR, CRC ( A ) | pMMR, CRC(B) | dMMR, 非 CRC(C) | |
免疫相关 客观反应率 (%) | 40 | 0 | 71 |
95%CI | 12-74 | 0-20 | 29-96 |
免疫相关 20 周 无进展生存率 (%) | 78 | 11 | 67 |
95%CI | 40-97 | 1-35 | 22-96 |
中位随访时间 ( 周 ) | 36 | 20 | 21 |
图4 PD-1免疫治疗获益的12种肿瘤类型
至于dMMR患者为什么能从抗PD-1治疗获益的机制并不清楚。文献报道可能的机制:dMMR结直肠癌更容易被T细胞浸润。对肿瘤细胞分析发现dMMR结直肠癌在肿瘤浸润面、腺癌细胞间和肿瘤间质中有更多的CD8+以及辅助T细胞浸润。此外,dMMR与pMMR相比,突变累积,产生更多“新抗原(Neoantigen)”,更易被免疫系统识别,这也是获益的可能机制。
《2017 NCCN结直肠癌指南》推荐PD-1免疫治疗单抗pembrolizumab和nivolumab可用于dMMR/MSI-H结直肠癌晚期治疗。此外,5月23日,FDA批准Keytruda用于所有具有高度微卫星不稳定性(MSI-H)或者错配修复缺陷(dMMR)实体瘤患者的治疗。这是首次不分肿瘤类型,仅考虑肿瘤标志物治疗药物。从“同病异治”到“异病同治”,具有划时代的意义。
图5 PD-1/PD-L1与dMMR
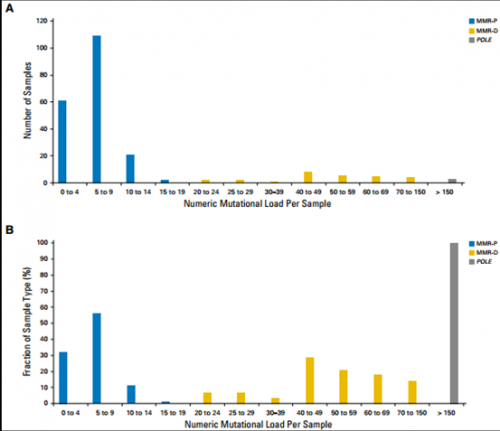
五:肿瘤负荷肿瘤突变负荷(Tumor Mutation Burden,TMB),通常定义为每个癌症病人外显子测序每百万碱基(MB)的非同义突变数目。文献资料显示TMB可能成为肿瘤潜在的生物标记物。美国纪念斯隆-凯特琳癌症中心的Leonard B. Saltz等报告的一项研究对224例结直肠癌患者通过自定义杂交捕获进行二代测序,肿瘤突变负荷按照除拷贝数及结构重排的非同义突变数目计算,并同时进行免疫组化检测错修复基因表达水平。研究发现193例错配修复基因正常(pMMR)患者突变数<20;突变数≥20的31例患者中,28例(90%)是错配修复基因缺陷(dMMR)。剩余的3例因为维护基因组稳定的基因PLOE发生P286R突变,伴有高负荷突变,导致3例pMMR突变数均>150,这种情况也很容易被识别。
图6 结直肠癌中的肿瘤突变负荷情况
如图6所示,作者将突变负荷设定为≥20且<150定义为dMMR,,则用基因二代测序预测MMR的状态的灵敏度和特异性都是1.0(95%CI,0.93~1.0)。该研究基于dMMR肿瘤中突变累积较多,将MMR状态与肿瘤负荷建立对应关系。提示TMB可作为结直肠癌MMR检测的标志物。
基因科技相关产品(一) 错修复蛋白(免疫组化法)
名称 | 货号 | 克隆号 |
MLH1 | GT2189 | ES205 |
MSH2 | GT2105 | 25D12 |
MSH6 | GT2195 | EP49 |
PMS2 | GT2159 | EP51 |
(二) 焦磷酸测序技术服务
焦磷酸测序以目标DNA的一条单链为模板,以测序引物作为引导链,通过四种酶的级联反应将核苷酸链的延伸过程转化成荧光信号。
1 MLH1 甲基化检测
MLH1 属于 MMR 家族的错配修复基因,是细菌错配修复基因 mutL 的同源物。该基因定位于 3p21,其基本功能是与其它的 MMR 蛋白相互作用形成一种多聚复合物,消除 DNA 复制过程中由于 DNA 聚合酶滑移而引起的碱基错配、插入以及缺失的形成。MHL1 基因启动子区的甲基化与多种肿瘤的发生发展密切相关。
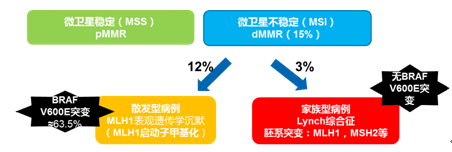
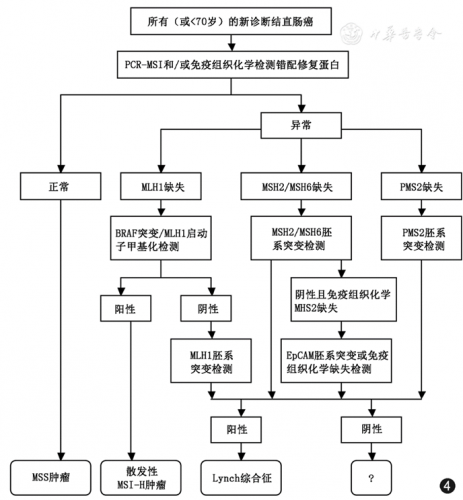
在结直肠癌中,15%经MSI途径发生。其中约12%为散发性 MSI 结直肠癌,发生机制为MLH1 基因启动子发生甲基化使该基因沉默、发生微卫星不稳定性而致的 CRC。此外,由 MLH1、 PMS2、 MSH2、 MSH6 等 MMR 基因发生胚系突变所致Lynch 综合征,约占3%。如图7所示,lynch综合征与散发性MSI结直肠癌的鉴别筛查过程中,MLH1启动子甲基化检测在筛查中起重要作用。
图7:lynch综合征与散发性MSI结直肠癌的鉴别筛查过程
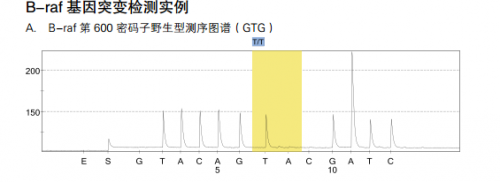
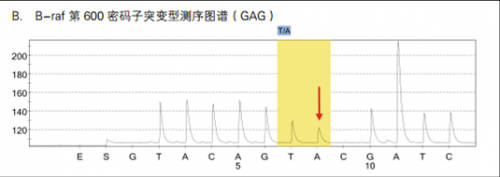
2 B-raf 基因突变检测
B-raf 是一种癌基因,它编码一种丝/苏氨酸特异性激酶,是RAS/RAF/MEK/ERK/MAPK 通路重要的转导因子,参与调控细胞内多种生物学事件,如细胞生长、分化和凋亡等。研究表明,在多种人类恶性肿瘤中,如恶性黑色素瘤、结直肠癌、肺癌、甲状腺癌、肝癌及胰腺癌等均存在不同比例的 B-raf 基因突变,约 66% 恶性黑色素瘤和15%的结肠癌中 B-raf 基因存在体细胞错义突变。大约 80-90% 的 B-raf 基因突变发生在 exon15的 1799 核苷酸上,T 突变为 A,导致其编码的谷氨酸由缬氨酸取代 (V600E)。目前认为,V600E 突变可模拟 T599 和 S602 两个位点的磷酸化过程,从而使 B-raf 蛋白异常激活。
在结直肠癌中,散发性的MSI结直肠癌约有63.5%存在B-raf V600E突变,但lynch综合征中基本无B-raf V600E突变。如图7所示,B-raf V600E突变可以用于lynch综合征与散发性MSI结直肠癌的鉴别诊断。
此外,2013 年 4 月出版的美国医学协会杂志(journal of american medical association,JAMA)报道了 BrafV600E 对甲状腺人乳头瘤(Papillary Thyroid Cancer, PTC)预后的影响。文章指出 BrafV600E 突变极大的影响了 PTC 病人的存活率等一系列预后指标。B-raf 突变状态与多种肿瘤的发生、发展及临床结局有关。随着 B-raf 突变研究的深入,可望为阐明肿瘤发生的分子机制,寻找新的治疗途径与靶点提供思路。
参考文献:
参考文献太多,此处不一一列举。